在怀孕的过程中,如果母体受到了病原体入侵感染,那么,母体的免疫系统就会在不伤害胎儿的前提之下,启动免疫响应,抑制病原体复制【1,2】。而在某些情况之下,比如子宫感染,那么胚胎炎症也就不可避免,甚至会造成难产和死胎等等严重的后果【3,4,5】,在此过程中,胚胎的一型干扰素信号通路起到了至关重要的作用。在怀孕过程中,有些病菌感染,比如流感病毒感染,是经常发生的。流感病毒可以激活母体一型干扰素信号,从而可以有效抑制病毒复制,而对胎儿影响却不大【6,7,8,9】。因此,机体中应该存在这样一类保护机制,在病原体入侵时,既可以在感染部位启动干扰素信号通路,又可以避免母体的干扰素对胎儿的伤害。
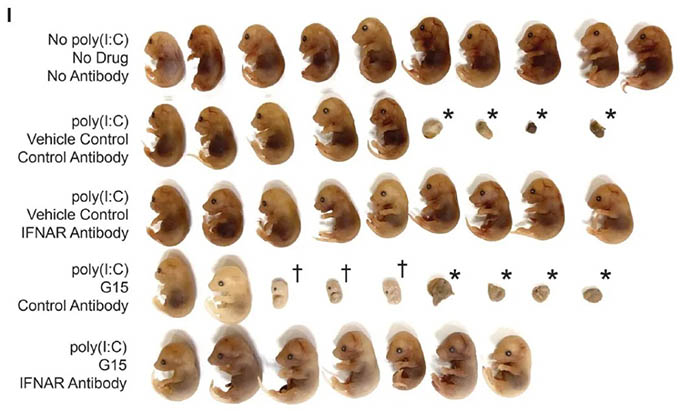
近日,来自美国杜克大学的Nicholas S Heaton研究组在Science上发表题为GPER1 is required to protect fetal health from maternal inflammation的文章,发现鸟苷酸结合蛋白偶联的雌激素受体1(guanine nucleotide–binding protein–coupled estrogen receptor 1,简称GPER1)可以在母体发生炎症时,通过调控干扰素信号,有效保护胎儿。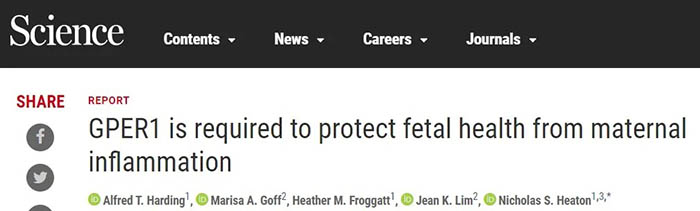
参考文献
1. K. Racicot, J. Y. Kwon, P. Aldo, M. Silasi, G. Mor, Am. J. Reprod. Immunol. 72, 107–116 (2014). 2. G. Mor, I. Cardenas, V. Abrahams, S. Guller, Ann. N. Y. Acad. Sci. 1221, 80–87 (2011). 3. C. B. Coyne, H. M. Lazear, Nat. Rev. Microbiol. 14, 707–715 (2016). 4. L. J. Yockey et al., Sci. Immunol. 3, eaao1680 (2018). 5. J. Buchrieser et al., Science 365, 176–180 (2019). 6. Y. Nagaoka et al., Dis. Markers 2017, 2594231 (2017). 7. M. T. McClain et al., Clin. Exp. Immunol. 183, 441–451 (2016). 8. C. Hansen et al., J. Infect. Dis. 206, 1260–1268 (2012). 9. S. A. McNeil et al., Am. J. Obstet. Gynecol. 204, S54–S57 (2011). 10. R. De Hertogh, K. Thomas, J. J. Hoet, I. Vanderheyden, Diabetologia 12, 455–461 (1976). 11. M. A. Pazos, T. A. Kraus, C. Muñoz-Fontela, T. M. Moran, PLOS ONE 7, e40502 (2012).













